Na epilepsia refratária, acrescentar uma terceira droga antiepilética (DAE), para casos sem controle sustentável de crises convulsivas, contribui muito mais para exposição a riscos e efeitos colaterais do que o controle da doença. É mais racional avaliar a possibilidade de substituições de medicamentos. Para a grande maioria dos casos refratários, a cannabis medicinal pode ser a solução. Um óleo ou extrato de cannabis rico em CDB para uso oral, além de ser muito melhor tolerado no quesito “efeitos colaterais”, é seguro devido à ausência de receptores canabinoides no centro da respiração, e ainda promove a retirada das perigosas DAE, com seus deletérios efeitos colaterais, o que torna a vida do paciente e seus familiares muito mais suportável.
Os fármacos antiepilépticos diminuem a excitabilidade da membrana, aumentam a inibição pós-sináptica ou alteram a sincronização das redes neurais para diminuir a excitabilidade neuronal excessiva associada ao desenvolvimento de convulsões. Entretanto, os efeitos colaterais comuns da diminuição da excitabilidade neuronal são resposta motora e psicomotora lentas, déficit de atenção o comprometimento da memória [1].
Ao contrário dos adultos, os efeitos colaterais cognitivos em crianças ocorrem no contexto do desenvolvimento cognitivo e psicossocial normal da infância, e as decisões de tratamento tomadas na infância podem ter implicações ao longo da vida. Os adultos, que desenvolveram epilepsia durante a infância, tendem a ter menos educação por deficiência no aprendizado, menores taxas de emprego e emprego menos qualificados, níveis mais baixos de matrimônio, menor saúde física e maior incidência de transtornos psiquiátricos [2].
É importante notar que esses efeitos em longo prazo também estão presentes em adultos que não estão mais tomando medicamentos anticonvulsivantes. A persistência destes efeitos, após a interrupção do tratamento com drogas antiepiléticas (DAE), sugere um papel quer da etiologia das crises convulsivas, dos efeitos cumulativos das crises repetidas e da terapêutica com DAE que altera permanentemente o curso do desenvolvimento. Como o comprometimento cerebral significativo e as crises mais frequentes estão associados a uma epilepsia refratária, é improvável que esses pacientes interrompam seus medicamentos para convulsões.
Estudos experimentais “in vivo” demonstraram efeitos significativos de DEA no cérebro em desenvolvimento incluindo neurodegeneração apoptótica, ou seja redução de células nervosas [3]. Assim, efeitos colaterais DAE de longo prazo devem ser considerados ao selecionar um anticonvulsivante para uso pediátrico.
Os efeitos colaterais do DAE no cognitivo em crianças, infelizmente, não têm sido estudados [4]. Embora vários padrões de tratamento com DAE em adultos jovens continuem a ser descritos, a falta de dados necessários para gerar evidências que possam orientar o uso de DAE em crianças é preocupação da Academia Americana de Neurologia (AAN), Child Neurology Society (CNS) e Academia Americana De Pediatria (AAP). Uma diretriz de prática, recente destas entidades médicas, afirmou que “os efeitos colaterais comportamentais e cognitivos precisam ser melhor avaliados, especialmente para a novas DAE, e os riscos individuais, bem como as diferenças de grupo avaliadas em testes de cognição” [5].
Fenobarbital e benzodiazepínicos tradicionais estão associados com o maior risco de efeitos colaterais cognitivos. Os efeitos do fenobarbital estão bem estabelecidos, uma vez que foi utilizado durante muitos anos para a profilaxia de convulsões. Embora já não seja uma terapia de primeira linha, seus efeitos sobre o coeficiente de inteligência (QI) ilustram um padrão de preocupação que requer um exame cuidadoso em todas as outras DAE. Em estudos, crianças com fenobarbital apresentaram quedas de QI [6] [7], e embora o QI melhorasse após a descontinuação do uso, os prejuízos continuaram a ser detectados em longo prazo quando estas crianças foram testadas três a cinco anos mais tarde [8].
A incapacidade das crianças de recuperar e compensar completamente o “tempo perdido” é importante porque sugere uma interação mais complexa da terapia com DAE e maturação do desenvolvimento do que simplesmente interferir com a nova eficiência de aprendizagem. Como as quedas de QI podem refletir o crescimento mental retardado em vez de uma perda da função cognitiva previamente adquirida ou regressão cognitiva, existe preocupação que qualquer DAE, com efeitos colaterais cognitivos importantes, pode resultar em prejuízo significativo com base em efeitos cumulativos se usado durante longos períodos de tempo.
Os efeitos colaterais cognitivos da carbamazepina, fenitoína, e valproato sódico / ácido valpróico são comparáveis e associados a uma desaceleração psicomotora modesta acompanhada de diminuição da atenção e da memória. Os efeitos colaterais neuropsicológicos geralmente sugerem relação dose-dependente [1]; Entretanto, tanto a qualidade de vida quanto à memória podem ser afetadas, mesmo quando as concentrações sanguíneas séricas estão dentro de intervalos terapêuticos padrões [9]. Além de desaceleração no eletroencefalograma (EEG), parece existir uma relação entre o tamanho desta desaceleração e o declínio na escala de Inteligência Wechsler para crianças (WISC-R) em crianças testadas após um ano de terapia [10].
O topiramato tem seu uso pediátrico liberado pelo Food and Drug administration (FDA) nos EUA, embora existam provas, obtidas de diversas fontes que, em certas doses, existe um risco de deficiência neuropsicológica [11]. Estudo multicêntrico americano, envolvendo 2860 pacientes epiléticos, constatou que 15% tinham Efeitos Colaterais Cognitivos Intoleráveis (ECCI) atribuídos a pelo menos um DAE. Na poli terapia, uso concomitante de mais de uma DAE, verificou-se que as ECCI eram mais comumente observadas com topiramato (22,8% de 281 pacientes), significativamente mais do que com quase todos os outros DAEs. O mesmo foi observado em monoterapia, os ECCI em decorrência do uso do topiramato (18,5% de 54 pacientes) foram superiores aos observados com gabapentina, carbamazepina, lamotrigina e levetiracetam [12].
A maioria das crianças, portadoras de epilepsia refratária, fazia uso de três ou mias drogas anticonvulsivantes associadas que, na maioria das vezes, não são capazes de controlar as crises convulsivas de modo sustentado. O Estudo Observacional Associação Brasileira de Pacientes de Cannabis Medicinal (AMA+ME): Uso de óleo de cannabis rico em canabidiol para controle de epilepsia refratária, identificou, no universo de 38 pacientes, o uso de três ou mais drogas em 92% dos pacientes epiléticos associados (33/36). As mais utilizadas estão discriminadas no quadro abaixo.
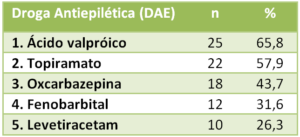
Para fins de esclarecimentos, principalmente focado em efeitos colaterais, advertências e riscos de vida relacionados às DAE, abordaremos as três drogas mais utilizadas pelos associados epiléticos refratários da AMA+ME que correspondem às mais prescritas no país para tratamento de epilepsia refratária: ácido valpróico, topiramato, oxcarbazepina. Também abordaremos o óleo de cannabis para uso oral.
Droga Antiepiléticas (DAE)
01. Ácido valproico / valproato
Droga utilizada por 2/3 dos epiléticos refratários associados da AMA+ME, na sua maioria crianças. O produto, segundo o fabricante não é recomendado para menores de 10 anos, entretanto é o medicamento anticonvulsivante mais prescrito pelos neurologistas no mundo, e no Brasil não é diferente, mesmo para crianças epiléticas refratárias menores de 10 anos que persistem com convulsões, principalmente as parciais complexas, apesar do uso concomitante de outras DAE. Os efeitos colaterais e deletérios, em longo prazo, não são citados na bula do medicamento.
Os efeitos colaterais observados em cinco ou mais por cento dos pacientes em monoterapia com ácido valpróico estão apresentados no gráfico 01. Mais de 1/3 dos pacientes que utilizam ácido valpróico isolado para tratamento de epilepsia sofrem astenia (perda de força), sonolência, cefaleia, náuseas e vômitos.
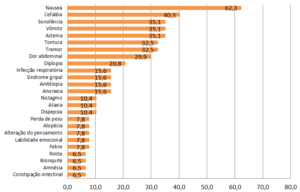
Gráfico 01: Frequência dos efeitos colaterais atribuídos ao ácido valpróico nos pacientes em monoterapia (%)
Pacientes que utilizam ácido valpróico em doses elevadas, acimas de 30 mg/kg/dia, demandam atendimento de emergência, ver no gráfico 03. Mais de 40% dos pacientes precisaram recorrer a atendimento médico devido a tremores em excesso. A maioria dos epiléticos refratários associados da AMA+ME utilizava doses entre 30 e 60 mg/kg/dia.
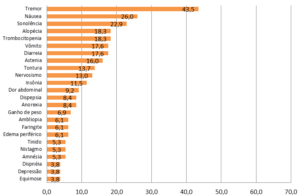
Gráfico 02: Frequencia de efeitos colaterais atribuídos ao ácido valpróico na dosagem elevada (> 30 mg/kg/dia que demandaram tratamento emergencial
Outros efeitos colaterais observados em mais e 1 % e menos 5% dos pacientes em monoterapia com ácido valpróico são: gerais: dor nas costas, dor no peito, mal estar; sistema cardiovascular: taquicardia, hipertensão, palpitação; sistema digestivo: aumento do apetite, flatulência, hematêmese, eructação, pancreatite, abscesso periodontal; sistema linfático / hematológico: petéquias; distúrbios metabólicos e nutricionais: transaminases aumentadas; sistema musculoesquelético: mialgia, contração muscular, artralgia, cãibra na perna, miastenia; sistema nervoso: ansiedade, confusão, alteração na fala, alteração na marcha, parestesia, hipertonia, incoordenação, alteração nos sonhos, transtorno de personalidade; sistema respiratório: sinusite, tosse aumentada, pneumonia, epistaxe; pele e anexos: rash cutâneo, prurido, pele seca; órgãos dos sentidos: alteração no paladar, na visão e audição, surdez, otite média; sistema urogenital: incontinência urinária, vaginite, dismenorreia, amenorreia, poliúria.
Outros relatos de efeitos adversos, alguns graves e até óbitos foram atribuídos ao uso de ácido valpróico, são descritos abaixo:
Gastrintestinais: os efeitos colaterais mais frequentemente relatados no início da terapia são náusea, vômito e indigestão. São efeitos usualmente transitórios e raramente requerem interrupção do tratamento. Diarreia, dor abdominal e constipação foram relatadas. Tanto anorexia com perda de peso, quanto aumento do apetite com ganho de peso têm sido informados. A administração de comprimidos revestidos de divalproato de sódio, de liberação entérica, pode resultar na redução dos efeitos adversos gastrintestinais.
SNC: foram observados efeitos sedativos em pacientes submetidos a tratamento apenas com valproato de sódio; porém, esses são mais frequentes em pacientes recebendo terapias combinadas. A sedação geralmente diminui com a redução de outros medicamentos antiepilépticos administrados concomitantemente. Tremores (podem ser dose-relacionados), alucinações, ataxia, cefaleia, nistagmo, diplopia, asterixis, escotomas, disartria, vertigem, confusão, incoordenação motora, hiperestesia e parkinsonismo foram relatados com o uso do valproato. Raros casos de coma ocorreram em pacientes recebendo valproato isolado ou em combinação com fenobarbital. Em raros casos, encefalopatia, com ou sem febre desenvolveu-se logo após a introdução da monoterapia com valproato, sem evidência de disfunção hepática ou níveis plasmáticos inadequados. Embora a recuperação tenha sido descrita após a suspensão do medicamento, houve casos fatais em pacientes com encefalopatia hiperamonêmica, particularmente em pacientes com distúrbios do ciclo da ureia subjacente. Vários relatos mencionaram demência e pseudoatrofia reversível em associação com a terapia com valproato.
Dermatológicas: perda temporária de cabelos, erupções cutâneas, fotossensibilidade, prurido generalizado, eritema multiforme e síndrome de Stevens-Johnson (reação alérgica grave que se manifesta com erupções na pele e possui elevado risco de morte). Casos raros de necrólise epidérmica tóxica foram relatados incluindo um caso fatal num lactente de seis meses de idade recebendo valproato e vários outros medicamentos concomitantes. Um caso adicional de necrólise epidérmica tóxica resultante em óbito foi relatado num paciente com 35 anos de idade com AIDS, recebendo vários medicamentos concomitantes e com histórico de múltiplas reações cutâneas a medicamentos.
Psiquiátricas: observaram-se casos de labilidade emocional, depressão, psicose, agressividade, hostilidade, hiperatividade, deterioração do comportamento.
Hematológicas: foi relatada trombocitopenia. O valproato inibe a fase secundária da agregação plaquetária. Isso pode ser avaliado por alteração do tempo de sangramento, petéquias, hematomas, epistaxe ou hemorragia abundante. Linfocitose relativa, macrocitose, anemia incluindo macrocítica com ou sem deficiência de folato, pancitopenia, anemia aplásica, hipofibrinogenemia e porfiria aguda intermitente foram notadas, assim como leucopenia, eosinofilia e depressão de medula óssea.
Hepáticas: são frequentes pequenas elevações de transaminases (AST e ALT) e de DHL, que parecem estar relacionadas às doses. Ocasionalmente, os resultados de exames de laboratório incluem também aumentos de bilirrubina sérica e alterações de outras provas de função hepática. Tais resultados podem refletir hepatotoxicidade potencialmente grave.
Endócrino: menstruação irregular, amenorreia secundária, aumento das mamas, galactorréia e tumefação da glândula parótida, testes da função da tireoide anormal. Existem relatos espontâneos de ovário policístico. A relação causa e efeito não foi estabelecida.
Pancreáticas: foi relatada pancreatite aguda em pacientes recebendo valproato, incluindo raros casos fatais.
Metabólicas: hiperamonemia hiponatremia e secreção de hormônio antidiurético alterada. Existem raros relatos de síndrome de Fanconi ocorrendo principalmente em crianças. Hiperglicemia foi associada à fatalidade em um paciente com hiperglicemia não cetótica preexistente.
Órgãos dos sentidos: perda da audição, irreversível ou reversível, foi relatada; no entanto, a relação causa e efeito não foi determinada. Dor no ouvido também foi relatada.
Urogenitais: enurese, infecção do trato urinário.
Outras: anafilaxia, edema de extremidades, lúpus eritematoso, dor nos ossos, tosse aumentada, pneumonia, otite média, bradicardia, vasculite cutânea, febre e hipotermia. Mania: calafrios, dor na nuca, rigidez do pescoço. Sistema cardiovascular: hipotensão, hipotensão postural, vasodilatação. Sistema digestivo: incontinência fecal, gastroenterite, glossite. Sistema musculoesquelético: artrose. Sistema nervoso: agitação, reação catatônica, hipocinesia, reflexo aumentado, discinesia tardia, vertigem. Pele e anexos: furunculose, erupções maculopapulares, seborreia. Sentidos especiais: conjuntivite, olho ressecado, dor ocular. Sistema urogenital: disúria. Enxaqueca: apesar da segurança e eficácia do valproato de sódio não terem sido avaliadas na profilaxia de enxaqueca, os seguintes eventos adversos não listados anteriormente foram relatados por 1% ou mais dos pacientes em dois estudos clínicos placebo-controlados com divalproato de sódio em comprimidos. Gerais: edema facial. Sistema digestivo: boca seca, estomatite. Sistema urogenital: cistite, metrorragia e hemorragia vaginal. Efeitos adversos relacionados à dose: a frequência de efeitos adversos (particularmente a elevação de enzimas hepáticas e trombocitopenia) pode estar relacionada à dose que deve ser monitorada por exames laboratoriais trimestrais. O benefício de um melhor efeito terapêutico com doses mais altas deve ser avaliado contra a possibilidade de uma maior incidência de eventos adversos.
ADVERTÊNCIAS
Hiperamonemia que determina transtorno metabólico grave (elevação de amônia no sangue) foi relatada associada à terapia com valproato, podendo estar presente mesmo em pacientes com testes de função hepática normal. Em pacientes que desenvolvem letargia inexplicável e vômitos ou alterações no estado mental, o diagnóstico de encefalopatia por hiperamonemia deve ser considerado e os níveis de amônia devem ser avaliados. Se os níveis de amônia estiverem aumentados, o ácido valpróico deve ser descontinuado. Os níveis plasmáticos de amônia no sangue devem ser rigorosamente controlados. Se a elevação persistir, o tratamento com valproato de sódio deverá ser descontinuado.
A administração concomitante do topiramato, segunda droga antiepilética mais utilizada pelos epiléticos associados da AMA+ME, e do ácido valpróico foi associada com hiperamonemia, com ou sem encefalopatia, nos pacientes que toleraram uma ou outra droga isoladamente. Os sintomas clínicos da encefalopatia hiperamonêmica incluem frequentemente alterações agudas no nível de consciência e/ou na função cognitiva, com letargia e vômitos. Na maioria dos casos, os sintomas e os sinais diminuem com a descontinuação de uma ou outra droga. Não se sabe se a monoterapia com o topiramato pode estar associada com hiperamonemia. Os pacientes com erros inatos do metabolismo ou com atividade mitocondrial hepática reduzida podem apresentar risco aumentado de desenvolver hiperamonemia, com ou sem encefalopatia. Embora não estudada, a interação do topiramato e do ácido valpróico pode exacerbar defeitos existentes ou revelar deficiências em pessoas suscetíveis. Gerais: pelo fato de terem sido relatados casos de alterações na agregação plaquetária, trombocitopenia e anormalidade nos parâmetros de coagulação (ex.: baixo fibrinogênio), recomenda-se realização de contagem de plaquetas e testes de coagulação antes de iniciar o tratamento e depois, periodicamente. Recomenda-se a realização desses exames em pacientes recebendo ácido valpróico ou valproato de sódio antes de cirurgias eletivas. Vinte e sete por cento dos pacientes utilizando doses superiores a 50mg/kg/dia apresentam níveis de plaquetas, no plasma, iguais ou inferiores 75 x 109/L o que eleva muito o risco de hemorragias importantes.
Uma vez que o valproato pode interagir com medicamentos administrados concomitantemente capazes de induzir enzimas, determinações periódicas da concentração plasmática de valproato e medicamentos concomitantes são recomendados durante a terapia inicial. O valproato é eliminado parcialmente pela urina, como metabólito cetônico, o qual pode prejudicar a interpretação correta dos resultados do teste de corpos cetônicos na urina. Há relatos de testes da função da tireoide alterados associados ao valproato. Desconhece-se o significado clínico desse fato. Há estudos in vitro que sugerem que o valproato estimula a replicação dos vírus da AIDS (HIV) e citomegalovírus (CMV) em certas condições experimentais. A consequência clínica, se houver, não é conhecida. Adicionalmente, a relevância dessas descobertas in vitro é incerta para pacientes recebendo terapia antirretroviral supressiva máxima. Entretanto, estes dados devem ser levados em consideração ao se interpretar os resultados da monitorização regular da carga viral em pacientes infectados pelo HIV recebendo valproato, ou no acompanhamento clínico de pacientes infectados por CMV.
Reações de hipersensibilidade de múltiplos órgãos foram raramente relatadas com associação temporal relacionada ao início da terapia com o valproato em adultos e em pacientes pediátricos. Embora houvesse um número limitado de relatos, muitos destes casos resultaram em hospitalização. Os sinais e os sintomas deste distúrbio eram diversos; entretanto, os pacientes tipicamente, embora não exclusivamente, apresentaram febre e erupções cutâneas, com envolvimento de outros órgãos do sistema. Outras manifestações associadas podem incluir linfadenopatia, hepatite, anormalidade de testes de função do fígado, anormalidades hematológicas (por exemplo, eosinofilia, trombocitopenia, neutropenia), prurido, nefrite, oligúria, síndrome hepato-renal, artralgia e astenia. Como o distúrbio é variável em sua expressão, sinais e sintomas de outros órgãos não relacionados aqui podem ocorrer. Se houver suspeita desta reação, o valproato deve ser interrompido e um tratamento alternativo ser iniciado. Embora a existência de sensibilidade cruzada com outras drogas que produzem esta síndrome não seja clara, a experiência com drogas associadas à hipersensibilidade de múltiplos órgãos indicaria que isso é possível.
Hepatotoxicidade: casos de insuficiência hepática resultando em fatalidade têm ocorrido em pacientes recebendo ácido valpróico. Estes incidentes usualmente têm ocorrido durante os primeiros seis meses de tratamento. Hepatotoxicidade grave ou fatal pode ser precedida por sintomas não específicos como mal-estar, fraqueza, letargia, edema facial, anorexia, vômitos. Em pacientes com epilepsia, a perda de controle de crises também pode ocorrer. Os pacientes devem ser cuidadosamente monitorizados quanto ao aparecimento desses sintomas. Testes de função hepática deverão ser realizados antes do início da terapia e posteriormente com intervalos frequentes, especialmente durante os primeiros seis meses. No entanto, os médicos não devem confiar totalmente na bioquímica sérica, uma vez que estes exames podem não estar anormais em todos os casos sendo, portanto fundamental a obtenção de história clínica e realização de exames físicos periódicos. Deve-se ter muito cuidado quando valproato for administrado a pacientes com história anterior de doença hepática. Pacientes com múltiplos anticonvulsivantes, crianças, pacientes com doenças metabólicas congênitas, aqueles com doença convulsiva grave associada a retardo mental e paciente com doença cerebral orgânica podem apresentar um risco particular. A experiência tem demonstrado que crianças abaixo de dois anos de idade apresentam um risco consideravelmente maior de desenvolver hepatotoxicidade fatal, especialmente aquelas nas condições anteriormente mencionadas. Quando ácido valpróico/valproato de sódio for utilizado neste grupo de pacientes, deve ser usado com extrema cautela e como monoterapia. Os benefícios da terapia anticonvulsivante devem ser avaliados em relação aos riscos. Devido ao maior risco de hepatotoxicidade em crianças com menos de dois anos de idade, recomenda-se que o valproato seja usado como agente único. Acima deste grupo de idade, a experiência em epilepsia tem indicado que a incidência de hepatotoxicidade fatal decresce consideravelmente em pacientes mais velhos. A medicação deve ser descontinuada imediatamente na presença de disfunção hepática significante, suspeita ou aparente. Em alguns casos, a disfunção hepática progrediu apesar da descontinuação do medicamento.
Trombocitopenia: a frequência de efeitos adversos (particularmente enzimas hepáticas aumentadas e trombocitopenia) pode estar relacionada à dose e o risco. Lembrando que 27% doa pacientes utilizando doses de 50mg/kg/dia tem índice de plaquetas igual ou inferior a 75 x 109/L. O benefício terapêutico que pode acompanhar as maiores doses deverá, portanto, ser considerado contra a possibilidade de maior incidência de eventos adversos.
Distúrbios do ciclo da ureia (DCU): foi relatada encefalopatia hiperamonêmica, algumas vezes fatal, após o início do tratamento com valproato em pacientes com distúrbios do ciclo da ureia, um grupo de anormalidades genéticas incomuns, particularmente deficiência de ornitina-transcarbamilase. Antes de iniciar o tratamento com valproato a avaliação com relação à presença de DCU deve ser considerada nos seguintes pacientes:
- Com história de encefalopatia inexplicável ou coma, encefalopatia associada à sobrecarga proteica, encefalopatia relacionada com a gestação ou pós-parto, retardo mental inexplicável, ou história de amônia ou glutamina plasmática elevada;
- Com vômitos cíclicos e letargia, episódios de irritabilidade extrema, ataxia, baixos níveis de nitrogênio de ureia sanguínea, evacuação proteica;
- Com história familiar de DCU ou história familiar de óbitos infantis inexplicáveis (particularmente meninos);
- Com outros sinais ou sintomas de UDC.
Pacientes que desenvolverem sintoma ou encefalopatia hiperamonêmica inexplicável durante o tratamento com valproato, devem ser tratados imediatamente (incluindo a interrupção do tratamento com valproato) e serem avaliados com relação à presença de um distúrbio do ciclo da ureia subjacente.
Pancreatite: casos de pancreatite envolvendo risco de vida foram relatados tanto em crianças como em adultos que receberam valproato. Alguns desses casos foram descritos como hemorrágicos com rápida progressão dos sintomas iniciais para óbito. Alguns casos ocorreram logo após o início do uso, mas também após vários anos de uso. O índice baseado nos casos relatados excede o esperado na população em geral, e houve casos nos quais a pancreatite recorreu após nova tentativa com valproato. Pacientes e responsáveis devem ser advertidos para dor abdominal, náusea, vômitos e/ou anorexia, que podem ser sintomas de pancreatite, requerendo avaliação médica imediata. Se for diagnosticada pancreatite, o valproato deverá ser descontinuado. O tratamento alternativo para a condição médica subjacente deve ser iniciado conforme clinicamente indicado.
Carcinogênese, mutagênese e fertilidade: observou-se uma variedade de neoplasmas em ratos Sprague-Dawley e ICR (HA/ICR) recebendo ácido valpróico oralmente em doses de 80 e 170 mg/kg/dia, por dois anos (aproximadamente 10% a 50 % da dose diária humana máxima, em mg/m2). Os principais achados foram um aumento estatisticamente significante na incidência de fibrossarcomas subcutâneos em ratos machos recebendo altas doses de ácido valpróico e de adenomas pulmonares benignos relacionados à dose, em camundongos machos recebendo ácido valpróico. O significado desses achados para humanos não é conhecido até o momento. Aumento na frequência de alterações nas cromátides irmãs foi relatado em um estudo de crianças epilépticas recebendo valproato. Houve algumas evidências de que a frequência de SCE poderia estar associada com epilepsia. O significado biológico desse aumento não é conhecido. Estudos de toxicidade crônica em ratos e cães jovens e adultos demonstraram redução da espermatogênese e atrofia testicular com doses de 400 mg/kg/dia ou maiores em ratos (aproximadamente equivalente ou maior do que a dose diária humana máxima, em mg/m2), e doses de 150 mg/kg/dia ou mais em cães (aproximadamente 1,4 vezes maior que a dose diária máxima em humanos, ou mais, com base em mg/m2). Estudos de fertilidade de segmento I em ratos mostraram que doses orais de até 350 mg/kg/dia (aproximadamente igual à dose diária humana máxima, em mg/m2) por 60 dias não tiveram efeito na fertilidade. O efeito do valproato no desenvolvimento testicular e na produção espermática de fertilidade em humanos não é conhecido.
Uma vez que este medicamento pode produzir depressão do sistema nervoso central (SNC), especialmente quando combinado com outras substâncias que apresentam o mesmo efeito (por exemplo, álcool), os pacientes não devem se ocupar de tarefas de risco, como dirigir veículos ou operar máquinas perigosas, até que se tenha certeza de que estes pacientes não ficam sonolentos com o seu uso. Não ingerir concomitantemente com bebidas alcoólicas. É prudente informar ao médico sobre qualquer medicamento que o paciente esteja tomando, antes do início ou durante o tratamento. Medicamentos antiepilépticos não devem ser interrompidos repentinamente devido a grande possibilidade de precipitação de status epileticus seguido de hipóxia e elevado risco de vida. A interrupção repentina do tratamento com este medicamento cessará o efeito terapêutico, o que poderá ser danoso ao paciente devido às características da doença para a qual este medicamento está indicado.
Segundo Leandro Ramires, médico, presidente da AMA+ME e pai do Benício de quase nove anos, portador da síndrome de Dravet, epilético refratário e autista severo, após conhecimento deste extenso rol de efeitos adversos extremamente perigosos, é triste constatar que muitos epiléticos associados, após vários anos de uso do ácido valpróico ou valproato, de forma isolada ou em associações, percebem que a retirada desta medicação pouco, ou em nada, altera o quadro epilético refratário. Ainda segundo Leandro, iniciar uma nova DAE é fácil, retirá-la é bem mais complicado. Muitas vezes, sem efeito sobre a epilepsia, crianças já prejudicadas pela doença de base, são forçadas a sentir na pele muitos desses efeitos, e riscos de vida, descritos aqui por impotência médica diante da refratariedade dos casos. Essa impotência acaba gerando atitudes imprudentes repletas de “boas intenções” de alguns médicos que submetem seus pacientes epiléticos a mais danos do que soluções.
2. Topiramato
Com o topiramato é droga mais nova se comparada ao ácido valpróico / valproato, a literatura disponível a respeito dos efeitos colaterais atribuíveis exclusivamente ao topiramato para tratamento de epilepsia são restritas. A maioria dos pacientes usa essa droga em associação com outras DAE. As informações da bula do fabricante sobre os efeitos colaterais são descritas abaixo.
Pacientes Adultos: com base em estudos clínicos controlados com placebo, nos quais houve um rápido período de tratamento, pode-se estabelecer que as reações adversas mais comuns estão relacionadas, principalmente, com o SNC e incluíram: sonolência, tontura, nervosismo, ataxia, fadiga, distúrbios da fala, alterações do raciocínio, alterações da visão, dificuldade de memorização, confusão mental, parestesia, diplopia, anorexia, nistagmo, náusea, perda de peso, distúrbios de linguagem, distúrbios da concentração/atenção, depressão, dor abdominal, astenia e alterações do humor. Os efeitos colaterais observados com menor frequência, mas que foram considerados relevantes do ponto de vista clínico incluíram: alteração do paladar, agitação, problemas cognitivos, labilidade emocional, problemas de coordenação, marcha anormal, apatia, sintomas psicóticos, reação / comportamento agressivo, leucopenia, nefrolitíase e tromboembolia. Em estudos clínicos em duplo-cego, envolvendo pacientes adultos em monoterapia com topiramato, os eventos adversos clinicamente relevantes, ocorrendo com incidência maior ou igual a 10% dos pacientes, foram: parestesia, cefaleia, tontura, fadiga, sonolência, perda de peso, náusea e anorexia.
Pacientes Pediátricos: em estudos clínicos em duplo-cego realizados em crianças os eventos adversos observados com maior frequência foram: sonolência, anorexia, fadiga, nervosismo, distúrbio da personalidade, dificuldade de concentração/atenção, reação agressiva, perda de peso, marcha anormal, alterações do humor, ataxia, aumento da salivação, náusea, dificuldade de memorização, hipercinesia, tontura, distúrbios da fala e parestesia. Os eventos adversos observados com menor frequência, mas que foram considerados relevantes do ponto de vista clínico, foram: labilidade emocional, agitação, apatia, problemas cognitivos, lentidão psicomotora, confusão, alucinação, depressão e leucopenia. Em estudos clínicos em duplo-cego, envolvendo pacientes pediátricos em monoterapia com topiramato, os eventos adversos clinicamente relevantes, ocorrendo com incidência maior ou igual a 10% nos pacientes, foram: cefaleia, fadiga, anorexia e sonolência.
Foram recebidos relatos de aumento nos testes de função hepática em pacientes recebendo topiramato com ou sem outros medicamentos. Ocorrem relatos isolados de hepatite e insuficiência hepática em pacientes recebendo diversas medicações concomitantes durante o tratamento com topiramato. Oligoidrose tem sido raramente relatada com o uso de Topiramato. A maioria destes relatos ocorreu em crianças. Acidose metabólica tem sido raramente relatada.
E interessante perceber que as informações sobre efeitos colaterais e riscos associados ao uso do topiramato, obtidas através da bula do medicamento, se assemelham aos efeitos deletérios do ácido valpróico. Como trata-se de uma DAE mais recente, será preciso esperar para se conhecer melhor seus efeitos colaterais e seus danos a longo.
Pesquisa PubMeD: “Death related to topiramate”
Existe um caso, descrito na literatura, que um paciente adulto, de 57 anos, faleceu em decorrência de insolação desencadeada por topiramato prescrito para tremor essencial [15].
3. Oxcarbazepina
Em estudos clínicos, as reações adversas observadas foram geralmente leves a moderadas em gravidade, de natureza transitória e ocorreram principalmente no início do tratamento. De maneira distinta das DAE referidas acima, o fabricante divide os efeitos colaterais em muito comuns, comuns, e raras.
São muito comuns, ocorrendo em 10 ou mais por cento dos pacientes em uso de oxcarbazepina: fadiga, tontura, dor de cabeça, náusea, vômito, sonolência e diplopia (visão dupla). São comuns, ocorrendo entre um e 10% dos pacientes: astenia, agitação, amnésia, apatia, ataxia, concentração prejudicada, confusão, depressão, instabilidade emocional, nervosismo, nistagmo, tremor e hiponatremia. São efeitos raros, mas não menos graves, a síndrome de hipersensibilidade de múltiplos órgãos, angioedema, linfadenomegalia, alterações na função hepática, eosinofilia, artralgia, arritmia cardíaca tipo bloqueio átrio ventricular com risco de óbito, trombocitopenia, hepatite, síndrome de Stevens-Johnson, lúpus eritematoso sistêmico.
Como DAE relativamente nova, faltam estudos consistentes em longo prazo para se estabelecer quais serão os impactos na saúde dos pacientes que fazem uso crônico da oxacabazepina.
Pesquisa PubMeD: “Death related to oxcarbazepine”
A intoxicação por oxcarbazepina foi considerada como uma possível causa de morte para 27 casos, as concentrações de 10-hidroxicarbazepina variaram de 2,2 a 48mg / kg com uma mediana de 25mg / kg [14].
Para evitar o risco de intoxicação grave, é prudente monitorar os níveis plasmáticos dos metabolitos da oxcarbazepina.
4. Óleo de cannabis para uso oral (OCE)
Os OCEs tem origem canábica, são produzidos através de cultivos medicinais. Nos EUA, são considerados suplementos alimentares e não medicamentos específicos. Como a produção dos OCEs não segue critérios padronizados de controle de qualidade e quantificação de canabinoides entre os diferentes produtores estrangeiros, um padrão uniforme de dosagem e administração ainda não é possível porque não se pode garantir a real concentração do CBD, outros canabinoides e outras substâncias que poderiam ter ação sobre o SNC em cada subproduto canábico produzido.
Foto: Bruno Figueiredo/Odin/Folhapress
Trinta e oito associados epiléticos refratários, associados da AMA+ME, foram incluídos no Estudo Observacional, pois se enquadravam na definição proposta pela International League Against Epilepsy (ILAE) ou seja, falha de resposta adequada com dois anticonvulsivantes, tolerados e apropriadamente usados, seja como monoterapia ou em combinação, para alcançar remissão de crises de modo sustentado [13]. Mais da metade. 22 (58%) utilizava um OCE há mais de 180 dias, 26 (68,4%) eram menores que 12 anos. Trinta (78,9%), dos 38 pacientes, reduziram o numero de crises convulsivas em mais de 50% e 39 (94,7%) tiveram a intensidade e duração das crises convulsivas diminuídas. Esses bons resultados, além de determinar redução de internações hospitalares e atendimentos de urgência e emergência, foram caracterizados pela boa tolerância aos OCEs com baixos efeitos colaterais, ver gráfico abaixo:
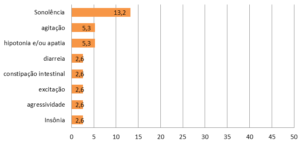
Gráfico 03: Percentual de efeitos colaterias atribuído ao óleo de cannabis rico em CBD no estudo AMA+ME Epilepsia Refratária (n 38)
Após 23 meses de seguimento, nenhum óbito foi registrado nos pacientes participantes do estudo realizado pela AMA+ME. Além de importante repercussão na redução dos efeitos colaterais comuns às DAE, o que aconteceu em 73% (27/37) dos pacientes, o uso OCE favoreceu o desenvolvimento psicomotor das crianças acompanhadas durante o estudo. A melhora observada no comportamento cognitivo e desenvolvimento neuropsicomotor permitirão um “futuro melhor” para os pacientes epiléticos refratários na infância. Estudos em longo prazo serão necessários para confirmar essa previsão.
Se compararmos a magnitude dos efeitos colaterais correspondentes observados simultaneamente durante o uso de OCE e ácido valpróico concluímos que o tratamento com cannabis determina efeitos colaterais mais suportáveis, ver gráfico 04.
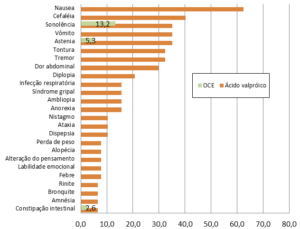
Gráfico 04: Frequência de efeitos colaterais atribuídos ao ácido valproico e OCE nos pacientes epiléticos refratários (%)
Referências:
- Meador KJ (2005), Cognitive effects of epilepsy and of antiepileptic medications. In: The Treatment of Epilepsy, Wyllie E, ed. Baltimore: Williams & Wilkins. [PubMed]
- Jalava M, Sillanpaa M (1997a), Physical activity, health-related fitness, and health experience in adults with childhood-onset epilepsy: a controlled study. Epilepsia 38(4):424-429. [PDF]
- Bittigau P, Sifringer M, Ikonomidou C (2003), Antiepileptic drugs and apoptosis in the developing brain. Ann N Y Acad Sci 993:103-114. [Abstract]
- Loring DW, Meador KJ (2004), Cognitive side effects of antiepileptic drugs in children. Neurology 62(6):872-877. [PubMed]
- Hirtz D, Berg A, Bettis D et al. (2003), Practice parameter: treatment of the child with a first unprovoked seizure: report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Society. Neurology 60(2):166-175. [PDF]
- Farwell JR, Lee YJ, Hirtz DG et al. (1990), Phenobarbital for febrile seizures-effects on intelligence and on seizure recurrence. [Published erratum N Engl J Med 1992;326(2):144.] N Engl J Med 322(6):364-369. [PDF]
- Wolf SM, Forsythe A, Stunden AA et al. (1981), Long-term effect of phenobarbital on cognitive function in children with febrile convulsions. Pediatrics 68(6):820-823. [PubMed]
- Sulzbacher S, Farwell JR, Temkin N et al. (1999), Late cognitive effects of early treatment with phenobarbital. Clin Pediatr (Phila) 38(7):387-394. [PubMed]
- Gilliam F (2002), Optimizing health outcomes in active epilepsy. Neurology 58(8 suppl 5):S9-S20. [PubMed]
- Frost JD Jr, Hrachovy RA, Glaze DG, Rettig GM (1995), Alpha rhythm slowing during initiation of carbamazepine therapy: implications for future cognitive performance. J Clin Neurophysiol 12(1):57-63. [PubMed]
- Salinsky MC, Storzbach D, Spencer DC et al. (2005), Effects of topiramate and gabapentin on cognitive abilities in healthy volunteers. Neurology 64(5):792-798. [PubMed]
- Javed A, Cohen B, Detyniecki K, et al. Rates and predictors of patient-reported cognitive side effects of antiepileptic drugs: An extended follow-up. Seizure. 2015 Jul;29:34-40. [PubMed]
- Fisher RS et al. A practical clinical definition of epilepsy, Epilepsia 2014; 55:475-482. [PDF]
- Linnet K, Steentoft A, Simonsen KW, et al. An oxcarbazepine-related fatality with an overview of 26 oxcarbazepine postmortem cases. Forensic Sci Int. 2008 May 20;177(2-3):248-51. [PubMed]
- Canel L, Zisimopoulou S, Besson M, Nendaz M. Topiramate-induced severe heatstroke in an adult patient: a case report. J Med Case Rep. 2016 Apr 13;10:95. [PDF]
Categoria: Editorial